

Питание - это
очень важно.
Я это знаю
совершенно
точно.
Оно должно
быть
разнообразным
сбалансирован-
ным, питатель-
ным, полезным.
И чтоб никаких
этих противных
мышей!!
МЯЯЯУУУ!!!
РАДИОпитание
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА
Воплощаю свой замысел, который родился у меня во время написания статьи «Постоянный ток».
Также, как и там, я не нумерую иллюстрации и почти не ссылаюсь на них в тексте, чтобы пытливый читатель (ежели таковой найдётся) сам догадался, какую именно мысль оные картинки визуализируют.
Использую кое-какие сокращения: ЭДС – электродвижущая сила, ХИТ – химические источники тока, ЭП – электрическое поле, АКБ – аккумуляторная батарея, ДВС – двигатель внутреннего сгорания, КПД – коэффициент полезного действия, ТЭ – топливный элемент.
Для общего представления о материале решил поместить в начале ПЛАН:
- Элементы истории
- «прототип» Луиджи Гальвани
- элемент Алессандро Вольта
- багдадская батарейка?
- Как работает гальванический элемент
- элемент Вольта
- элемент Лекланше, сухой элемент Лекланше
- Классификация ХИТ
- общая схема
- параметры
- Аккумулятор
- объяснение №1 посложнее
- объяснение №2 попроще
- недостатки
- Современные и будущие аккумуляторы
- водный
- сахарный
- шустрый литий-ионный
- самозаряжающийся
- новое слово о железо-никелевом
- растущий
- самый большой в мире
- Топливные элементы
- общее представление
- типы
- химические процессы
- отдельная ячейка
- автомобиль на ТЭ
- Эксперимент
- батарейки из фруктов и овощей
- Багдадская батарейка
- «на десерт»
1. Элементы истории
 Считается, что «прототип» гальванического элемента создал Луиджи Гальвани (1737-1798) — итальянский врач, анатом, физиолог и физик, один из основателей электрофизиологии и учения об электричестве, основоположник экспериментальной электрофизиологии. Он первым исследовал электрические явления при мышечном сокращении («животное электричество»). Гальвани описал процесс сокращения мышц задних лапок свежепрепарированной лягушки, закрепленных на медных крючках, при прикосновении стального скальпеля. Наблюдения были истолкованы первооткрывателем как проявление «животного электричества». С позиции обозначенной в заголовке темы, главным является то, что именно он обнаружил возникновение разности потенциалов при контакте разных видов металла и электролита.
Считается, что «прототип» гальванического элемента создал Луиджи Гальвани (1737-1798) — итальянский врач, анатом, физиолог и физик, один из основателей электрофизиологии и учения об электричестве, основоположник экспериментальной электрофизиологии. Он первым исследовал электрические явления при мышечном сокращении («животное электричество»). Гальвани описал процесс сокращения мышц задних лапок свежепрепарированной лягушки, закрепленных на медных крючках, при прикосновении стального скальпеля. Наблюдения были истолкованы первооткрывателем как проявление «животного электричества». С позиции обозначенной в заголовке темы, главным является то, что именно он обнаружил возникновение разности потенциалов при контакте разных видов металла и электролита.
Осуществив ряд экспериментов, Гальвани пришел к выводу о существовании нового источника и нового вида электричества. Его привели к такому выводу опыты составления замкнутой цепи из проводящих тел и металлов (лучше всего, по признанию самого учёного, было использовать разные металлы, например железный ключ и серебряную монету) и лягушечного препарата.
 Среди последователей болонского анатома оказался Алессандро Джузеппе Антонио Анастасио
Среди последователей болонского анатома оказался Алессандро Джузеппе Антонио Анастасио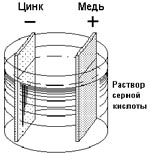 Джероламо Умберто Вольта (1745-1827) — итальянский физик, химик и физиолог, один из основоположников учения об электричестве.
Джероламо Умберто Вольта (1745-1827) — итальянский физик, химик и физиолог, один из основоположников учения об электричестве.
В 1800 году Алессандро Вольта (так коротко мы привыкли его называть со времён школьной физики) опустил в банку с кислотой две пластинки — цинковую и медную — и соединил их проволокой. После этого цинковая пластина начала растворяться, а на медной стали выделяться пузырьки газа. Вольта предположил и доказал, что по проволоке протекает электрический ток. Так был изобретён «элемент Вольта» — первый гальванический элемент.
Гальваническим элементом называются источники тока, в которых химическая энергия превращается в электрическую – это общее определение ХИТ.
В дальнейшем Вольта несколько видоизменил свой элемент, сделав из металлов диски, а между ними поместил прокладку из сукна, смоченного раствором кислоты. Он же обнаружил, что последовательное соединение таких элементов приводит к 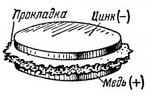 пропорциональному увеличению электрического напряжения. Вольта собрал батарею элементов в виде вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой. Вольтов столб высотою в полметра развивал напряжение, чувствительное для человека.
пропорциональному увеличению электрического напряжения. Вольта собрал батарею элементов в виде вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой. Вольтов столб высотою в полметра развивал напряжение, чувствительное для человека.
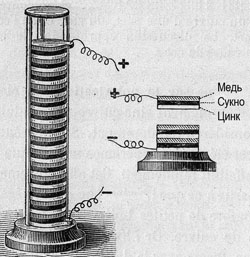
Извещение об открытии было им отправлено 20 марта 1800 года в письме президенту Лондонского Королевского общества Бэнксу. Письмо было доложено 26 июня того же года и произвело сенсацию не только в научном мире. Наполеон пригласил Вольта в Париж, лично присутствовал на демонстрации опыта, осыпал наградами и почестями.
Благодаря этим первым батареям постоянного тока были немедленно сделаны два выдающихся открытия:
- 1. Электролиз. В том же 1800 году Никольсон и Карлайл разложили воду на водород и кислород, а Дэви в 1807 году открыл металлический калий.
- 2. Электрическая дуга. В 1803 году русский физик Василий Петров создал самый мощный в мире вольтов столб, составленный из 4 200 медных и цинковых кругов и развивающий напряжение до 2500 вольт. С помощью этого прибора ему удалось открыть такое важное явление, как электрическая дуга, применяемая в электросварке; а в российской армии стал применяться электрический запал пороха и взрывчатки.
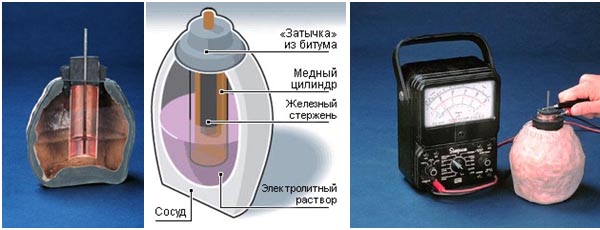
 Небольшое нелирическое (историческое) отступление. При раскопках парфянского поселения,
Небольшое нелирическое (историческое) отступление. При раскопках парфянского поселения,  существовавшего в Месопотамии 2200 лет назад, была обнаружен некий артефакт. Он представляет собой глиняный сосуд с пробкой из битума, которая протыкается железными прутами. Внутри банки пруты окружены медным цилиндром. Исходя из строения находки, её первооткрыватель, немецкий археолог Вильгельм Кёниг, предположил, что это древний гальванический элемент, который мог вырабатывать электрическое напряжение около 1 В. Он опубликовал статью об этом открытии в 1940 году. Действительно, с технической точки зрения банка очень схожа с электрохимическим источником постоянного тока наподобие гальванического элемента: разнородные металлы (железо и медь) помещены в керамический горшок из-под виноградного сока, куда наливали какой-то кислотный раствор. По-видимому, это устройство выполняло роль таинственного источника энергии в процессе нанесения гальванических покрытий из золота или серебра на поверхность металлических предметов. Украшения такого рода также были обнаружены археологами, а слои золота и серебра были столь тонки, что никаких других способов, кроме гальванизации, не предполагалось. Также открытым остается вопрос, почему технология изготовления таких батареек была утеряна, и в других регионах ничего подобного обнаружено не было.
существовавшего в Месопотамии 2200 лет назад, была обнаружен некий артефакт. Он представляет собой глиняный сосуд с пробкой из битума, которая протыкается железными прутами. Внутри банки пруты окружены медным цилиндром. Исходя из строения находки, её первооткрыватель, немецкий археолог Вильгельм Кёниг, предположил, что это древний гальванический элемент, который мог вырабатывать электрическое напряжение около 1 В. Он опубликовал статью об этом открытии в 1940 году. Действительно, с технической точки зрения банка очень схожа с электрохимическим источником постоянного тока наподобие гальванического элемента: разнородные металлы (железо и медь) помещены в керамический горшок из-под виноградного сока, куда наливали какой-то кислотный раствор. По-видимому, это устройство выполняло роль таинственного источника энергии в процессе нанесения гальванических покрытий из золота или серебра на поверхность металлических предметов. Украшения такого рода также были обнаружены археологами, а слои золота и серебра были столь тонки, что никаких других способов, кроме гальванизации, не предполагалось. Также открытым остается вопрос, почему технология изготовления таких батареек была утеряна, и в других регионах ничего подобного обнаружено не было.

Далеко не все ученые соглашаются, что багдадская банка может называться электрической, и считают, например, что она могла использоваться для хранения папирусов. Вполне возможно, что багдадская банка является случайным результатом чьих-то творческих изысканий…
2. Принцип действия гальванического элемента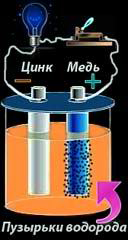
Рассмотрим, как работает элемент Вольта. В стеклянный сосуд, куда налит раствор серной кислоты, опущен цинковый стержень. Так как на поверхности пластины имеются положительно заряженные ионы цинка, то в растворе кислоты вокруг стержня концентрируются отрицательные ионы кислотного остатка. Силы притяжения ионов раствора отрывают ионы цинка. В результате цинковый стержень приобретает отрицательный потенциал, а раствор – положительный. А разность потенциалов - это напряжение. Таким образом, при контакте металла и кислотного раствора на границе возникает ЭП. В момент его образования и происходит превращение химической энергии в электрическую.
Элемент Вольта состоит из двух пластин – медной и цинковой, помещенных в слабый раствор серной кислоты. Медная пластина – это ПЛЮС, а цинковая – МИНУС. Следует учитывать, что ЭДС гальванического элемента полностью зависит от материала и от происходящих химических процессов.
 Подсоединив гальванический элемент к нагрузке, мы замкнём цепь – возникнет электрический ток. В процессе работы на медной пластине начинает выделятся водород. Образование пузырьков водорода отрицательно влияет на работу гальванического элемента, т.к. они создают барьер на границе меди и раствора. Это явление в физике называется «поляризация».
Подсоединив гальванический элемент к нагрузке, мы замкнём цепь – возникнет электрический ток. В процессе работы на медной пластине начинает выделятся водород. Образование пузырьков водорода отрицательно влияет на работу гальванического элемента, т.к. они создают барьер на границе меди и раствора. Это явление в физике называется «поляризация».
В 1868 французский химик Жорж Лекланше (1839 1882) разработал другой элемент. Его так и назвали в честь создателя – элемент Лекланше. В сосуд с раствором нашатыря, слегка разбавленного водой, помещены два стержня цинковый и графитовый. Последний имеет вокруг себя слой двуокиси марганца, задача которого как раз состоит в поглощении нежелательного водорода.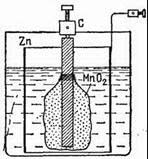
В результате эффективность гальванического элемента существенно возрастает. Именно так изготавливают большинство современных батареек. Отличия заключаются лишь в применяемых веществах и материалах, т.к. именно это влияет на специфические параметры и характеристики гальванических элементов. Например, одни расходуют свой заряд постепенно, при этом их ЭДС также будет постепенно уменьшаться. Другие, наоборот, более равномерно отдают свою энергию и лишь в самый последний момент резко теряют заряд.
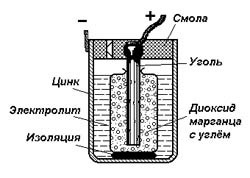
Ещё одна разновидность гальванических элементов – так называемые «сухие» марганец-цинковые элементы Лекланше. Вместо жидкого электролита в таком элементе используется гелеобразная паста из нашатыря и крахмала. Чтобы влага испарялась как можно меньше, верх такого элемента заливается воском или смолой с небольшим отверстием для выхода газов. Обычно элементы Лекланше изготавливаются в цилиндрических стаканчиках, которые одновременно служат и отрицательным электродом и сосудом.
 Начальное напряжение элемента составляло 1,4-1,6 В, конечное — 0,7-0,9 В. Уже через 2 года после изобретения свыше 20 тыс. элементов Лекланше использовалось в телеграфии.
Начальное напряжение элемента составляло 1,4-1,6 В, конечное — 0,7-0,9 В. Уже через 2 года после изобретения свыше 20 тыс. элементов Лекланше использовалось в телеграфии.
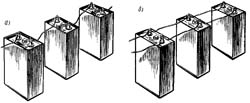
Соединять гальванические элементы можно последовательно (рис. а). При этом пропорционально взрастает общее напряжение, но и внутреннее сопротивление – тоже. При параллельном соединении (рис. б) пропорционально возрастает ток, который батарея может отдавать в нагрузку, а внутренне сопротивление, соответственно, становится меньше.
 Во всех батарейках элементы соединяются последовательно. Параллельное соединение используется значительно реже.
Во всех батарейках элементы соединяются последовательно. Параллельное соединение используется значительно реже.
В любом гальваническом элементе перераспределение электрических зарядов происходит за счёт химических реакций. Эти реакции необратимы, и, когда они завершаются, элемент полностью приходит в негодность.
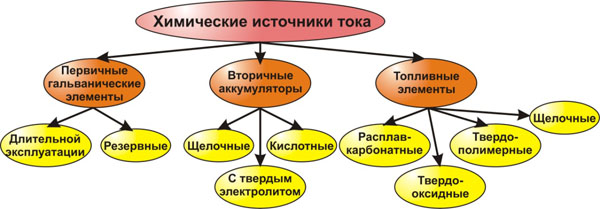
3. Классификация химических источников тока (ХИТ)
Все ХИТ (гальванические элементы и батареи из них) делятся на две группы – первичные (одноразовые или необратимые) и вторичные (многоразовые или обратимые). В первичных источниках тока (в просторечии – батарейках) химические процессы, как было сказано ранее, протекают необратимо, поэтому их заряд нельзя восстановить. К вторичным химическим источникам тока относят аккумуляторы, их заряд можно восстановить. Для широко распространённых аккумуляторов цикл заряд-разряд можно повторять около 1000 раз. Особое место среди ХИТ занимают топливные элементы.
|
ХИТ имеют различное напряжение и ёмкость. К примеру, обычные щелочные батарейки имеют номинальное напряжение около 1,5 В, а более современные литиевые – около 3 В. Хочу напомнить (см. мою статью «Постоянный ток»), что на корпусах элементов и батареек указывается значение ЭДС.
Для характеристики ёмкости аккумуляторов используется внесистемная единица электрического заряда 1 А×ч (Ампер-час). Заряженный аккумулятор с заявленной ёмкостью в 1 А·ч теоретически способен обеспечить силу тока 1 ампер в  течение одного часа (или, например, 10 А в течение 0,1 часа, или 0,1 А в течение 10 часов). На самом деле слишком большой ток разряда аккумулятора приводит к менее эффективной отдаче электроэнергии, что нелинейно уменьшает время его работы с таким током и может приводить к перегреву.
течение одного часа (или, например, 10 А в течение 0,1 часа, или 0,1 А в течение 10 часов). На самом деле слишком большой ток разряда аккумулятора приводит к менее эффективной отдаче электроэнергии, что нелинейно уменьшает время его работы с таким током и может приводить к перегреву.
На практике же ёмкость аккумуляторов приводят исходя из 20-часового цикла разряда до конечного напряжения. Для автомобильных аккумуляторов оно составляет 10,8 В. Например, надпись на маркировке аккумулятора «55 А·ч» означает, что он способен выдавать ток 2,75 А на протяжении 20 час, и при этом напряжение на клеммах не опустится ниже 10,8 В.
Часто также применяется производная единица миллиампер-час (мА·ч), которая используется обычно для обозначения ёмкости небольших аккумуляторов.
Величину в ампер-часах можно перевести в системную единицу измерения заряда — кулон (см. мою статью «Постоянный ток»). Поскольку 1 Кл/c равен 1 А, то, переведя часы в секунды, получаем, что 1 А·ч =3600 Кл.
Электрическая ёмкость зависит от множества факторов: количества элементов в батарее, уровня зарядки, температуры окружающей среды, тока отсечки (при котором устройство не работает даже при имеющемся заряде). Например, батарейка, которая уже не работает в фотоаппарате, зачастую продолжает работать в часах или пультах управления.
Благодаря техническому прогрессу увеличилось разнообразие миниатюрных устройств, работающих от батареек. Для многих из них потребовались более мощные элементы питания, при этом достаточно компактные. Литиевые батарейки стали ответом на такую потребность: долгий срок хранения, высокая надёжность и отличная работоспособность в широком диапазоне температур. На сегодняшний день самыми передовыми являются литий-ионные источники тока. Потенциал данной технологии ещё не раскрыт полностью, но ближайшие перспективы связаны с ними.
4. Аккумулятор
В 1859г Гастон Плантэ (1834-1889), французский ученый, разработал свинцово-кислотную  перезаряжаемую батарею (аккумулятор). Первый аккумулятор содержал два скрученных в рулон листовых проводника, разделенных резиновыми лентами и погруженных в 10% раствор серной кислоты. Годом позже Плантэ представил батарею, состоящую из девяти подобных
перезаряжаемую батарею (аккумулятор). Первый аккумулятор содержал два скрученных в рулон листовых проводника, разделенных резиновыми лентами и погруженных в 10% раствор серной кислоты. Годом позже Плантэ представил батарею, состоящую из девяти подобных  элементов, соединенных параллельно и помещенных в единый корпус. Батарея обеспечивала по тем временам весьма большой ток. Он также предложил метод формовки пластин для повышения ёмкости аккумуляторной батареи. После зарядки аккумулятор разряжался и снова заряжался током обратной полярности. Процесс повторялся несколько раз и занимал по времени около 3-х месяцев. В настоящее время усовершенствованный аккумулятор Плантэ используется в автомобилях.
элементов, соединенных параллельно и помещенных в единый корпус. Батарея обеспечивала по тем временам весьма большой ток. Он также предложил метод формовки пластин для повышения ёмкости аккумуляторной батареи. После зарядки аккумулятор разряжался и снова заряжался током обратной полярности. Процесс повторялся несколько раз и занимал по времени около 3-х месяцев. В настоящее время усовершенствованный аккумулятор Плантэ используется в автомобилях.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в водном растворе серной кислоты.
При подключении к электродам аккумулятора внешней нагрузки начинается электрохимическая реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца (в классическом варианте аккумулятора). Вообще говоря, электрохимические процессы в аккумуляторе сложны. Проведенные в СССР исследования показали, что при разряде аккумулятора протекает как минимум 60 различных реакций, порядка 20 из которых протекают без участия кислоты электролита (нехимические реакции).
Во время разряда происходит восстановление диоксида свинца на аноде (+) и окисление свинца на катоде (-). При заряде протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца начинается электролиз воды, при этом на аноде выделяется кислород, а на катоде — водород.
Электрохимические реакции (слева направо — при разряде, справа налево — при заряде):
реакции на аноде:
![]()
Реакции на катоде:
![]()
При разряде аккумулятора из электролита расходуется серная кислота и выделяется относительно более лёгкая вода, плотность электролита падает. При заряде происходит обратный процесс. В конце заряда, когда количество сульфата свинца на электродах снижается ниже некоторого критического значения, начинает преобладать процесс электролиза воды. Газообразные водород и кислород выделяются из электролита в виде пузырьков — происходит так называемое «кипение» при перезаряде. Это нежелательное явление, при заряде его следует, по возможности, избегать, так как при этом вода необратимо расходуется, нарастает плотность электролита и есть риск взрыва образующихся газов. Потери воды в результате электролиза восполняют доливкой в банки аккумулятора дистиллированной воды.
Повторение – мать учения, поэтому ещё раз же самое, но чуть иначе и без применения формул.
Итак, самый простой аккумулятор – это две свинцовые пластины, погруженные в электролит – раствор серной кислоты. При погружении свинцовых пластин в электролит серная кислота вступает в химическую реакцию со свинцом. В результате реакции на поверхности пластин появится налёт сернокислого свинца. Если теперь через эту свинцово-кислотную систему пропустить постоянный ток, то в ней начнётся химическая реакция. У пластины, которая соединена с «+» источника тока, сернокислый свинец станет перекисью свинца. Пластина примет коричневый цвет. Сернокислый свинец у пластины, которая соединена с «-» источника тока, превратится в губчатый свинец. Пластина приобретёт серый цвет.
В результате этих процессов плотность электролита повысится. Это произойдёт потому, что концентрация серной кислоты повысится, а часть волы поглотится.
На клеммах системы появится напряжение. Произошёл процесс зарядки аккумулятора, и система накопила некоторый запас энергии. Полностью заряженный и исправный кислотный аккумулятор имеет напряжение между клеммами порядка 2 В.
Если после зарядки аккумулятора к его полюсам подключить потребитель электроэнергии, во внешней цепи потечёт ток. В самом же аккумуляторе будет происходить химическая реакция, обратная предыдущей, из электролита будет поглощаться серная кислота и выделяться вода. Пластины аккумулятора снова покроются сернокислым свинцом, плотность электролита и напряжение на клеммах уменьшатся. Такой процесс называется разрядом аккумулятора.
Свинцово-кислотные аккумуляторы являются недорогими источниками постоянного тока из-за сравнительной дешевизны используемых в них материалов, а автоматизация производства ещё больше способствует их удешевлению.
Недостатки:
плохо сохраняют заряд;
имеют довольно большую массу;
выделяют во внешнюю среду водород;
их нельзя хранить в разряженном состоянии;
трудно изготовить такие аккумуляторы маленького размера и это далеко не все «минусы».
Но, как говорится, тем не менее…
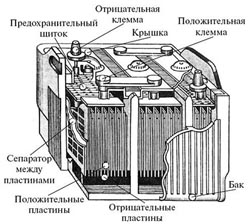
В заключение хочу отметить, что настоящие свинцово-кислотные аккумуляторы имеют гораздо более сложное устройство, чем аккумулятор Плантэ, да и электрохимические процессы, протекающие в них, многократно сложнее и многообразнее.
Резюмирую для упрощения:
При зарядке аккумулятора в нём протекают такие электрохимические реакции, в результате которых аккумулятор накапливает электрическую энергию и на его клеммах возникает разность потенциалов – напряжение. Электрохимические реакции обратимы. При замыкании клемм аккумулятора на какой-либо потребитель во внешней цепи возникает электрический ток – происходит разрядка, электрохимические реакции протекают в обратном порядке. Напряжение на клеммах аккумулятора постепенно уменьшается.
5. Современные и будущие аккумуляторы
Американцы решили осуществить второй по масштабам и значимости Манхэттенский проект, а именно за пять лет увеличить емкость современных аккумуляторов в пять раз и во столько же раз сделать их дешевле. Нынешний проект под названием «Battery and Energy Storage Hub» потребует усилий специалистов из пяти лучших университетов США, многих национальных лабораторий, а также частных компаний, работающих в области энергетики. За последнее время в мире накопилось столько новых изобретений в области сохранения энергии, что у американцев есть все реальные шансы решить намеченную задачу. Рассмотрим некоторые из подобных изобретений.
Водные аккумуляторы
Оказывается, в аккумуляторной батарее в качестве электролита можно использовать обыкновенную воду. Именно к такой идее пришел четыре года назад сотрудник Стэнфордского университета Колин Уэселлс. Являясь сегодня генеральным директором компании «Alveo Energy», он усиленно работает над продвижением водного аккумулятора на рынок.

Аккумуляторная батарея Колина Уэселлса использует в качестве электролита воду и специальный синий краситель – берлинскую лазурь. Заметим, что берлинская лазурь используется для окрашивания одежды, в частности джинсов, а также при производстве обычных цветных карандашей. Кроме этого, батарея Alveo Energy состоит из таких компонентов, как медь и железо, она имеет очень низкую стоимость по сравнению с современными аккумуляторами и отличается длительным сроком службы.
Колин Уэселлс и его компаньон по разработке данного аккумулятора профессор Роберт Хаггинс уже создали прототип новой АКБ и опубликовали данные о ее работе в журнале с месяц назад. Сегодня они трудятся над усовершенствованным образцом водного аккумулятора, который может работать без ухудшения характеристик не менее двух лет. Коммерческий же образец данной батареи, по мнению ученых, должен служить потребителю до десяти лет.
По сравнению с современными литий-ионными аккумуляторами водная батарея Alveo Energy будет иметь более низкие заряд (в три раза меньший) и напряжение, да и емкость ее меньше в десять раз, поскольку в структуре батареи только шестая часть ионов электрохимически активна. По объему она в несколько раз больше обычного аккумулятора, по этой причине ее вряд ли можно использовать в современном автомобиле.
Сегодня Колин Уэселлс и Роберт Хаггинс разрабатывают водный аккумулятор весом в пятьдесят килограммов, который должен обладать емкостью в один киловатт-час. Стоимость такого киловатт-часа обойдется потребителю в сто долларов. Для сравнения скажем, что самые дешевые современные свинцово-кислотные аккумуляторы обходятся в сто пятьдесят-двести долларов в расчете на один киловатт-час. А распространенные в автомобилях литий-ионные батареи в два-три раза дороже свинцово-кислотных. Так что перспектива у водных АКБ есть, особенно для производства больших стационарных аккумуляторов.
Сахарный аккумулятор
Для производства современных литий-ионных аккумуляторов Японии приходится закупать сырье на стороне, что отрицательно сказывается на торговым балансе страны. Именно по этой причине японские ученые постоянно ищут пути для создания АКБ на основе имеющегося у них сырья. И таким материалом стал… сахар. Сахарный аккумулятор, который недавно был разработан в Японии, по своим характеристикам более надежен и энергоемок, чем традиционно используемые аналоги, к тому же такая АКБ значительно дешевле.

Огромный спрос на литий, вызванный быстрым распространением в мире портативных аккумуляторов, вызывает озабоченность производителей батарей, поскольку данный материал добывается сегодня в политически нестабильных районах мира, например, в Аргентине, Чили, Боливии и так далее. Это стало второй причиной, по которой Япония начала вести активный поиск альтернативных решений для создания дешевых и надежных АКБ. В этом плане сахароза, по мнению японских ученых, может быть легко трансформирована в эффективный и недорогой материал для производства анода в литий-ионном аккумуляторе.
После нагрева сахарозы в вакууме и под большим давлением до температуры порядка 1500 градусов по Цельсию она превращается в углеродный порошок, который в натриево-ионных аккумуляторах позволяет повысить заряд до 300 мА×час, что на 20% выше, чем у обычных аналогов, имеющих высокопрочное углеродное соединение.
Конечно, это только первый шаг в деле разработки более эффективных и дешевых натриево-ионных батарей, тем не менее, японские ученые под руководством профессора Токийского университета Шиничи Комаба считают, что примерно через пять лет их группа сумеет выпустить коммерческую батарею, не уступающую современным аккумуляторам.
Несмотря на то что такие АКБ будущего сегодня еще не могут составить серьезной конкуренции обычным аккумуляторам по причине своих относительно низких основных показателей, многие исследователи и аналитики предполагают, что сахарные и подобные им батареи уже в течение ближайших пяти - десяти лет серьезно заявят о себе и постепенно начнут вытеснять слишком дорогие и неэффективные нынешние аналоги. Что ж, поживем – увидим.
Шустрый литий-ионный аккумулятор
Исследователи из южнокорейского Национального института науки и технологии Ульсана (UNIST) заявили, что ими разработан литий-ионный аккумулятор будущего, который может заряжаться в сто с лишним раз быстрее обычного, то есть буквально за несколько минут.

Хотя для производства катода новой АКБ используется стандартный материал (литий-оксид марганца), сам катод при этом помещается в специальный раствор с графитом, который образует на нем целую сеть проводящих каналов. Данная сеть графита позволяет всем без исключения элементам аккумулятора участвовать в подзарядке, что и ускоряет ее в сотню раз.
В обычных батареях все частицы заряжаются по очереди, согласно своему пространственному расположению, то есть сначала задействуются элементы возле электрона, затем – расположенные далее. АКБ исследователей UNIST объединяют катод с графитом и электролитом, благодаря чему аккумулятор становится быстрозаряжаемым.
Разработка ученых из Южной Кореи получила высокую оценку их коллег во всем мире, поскольку позволяет решить проблему подзарядки батарей на электрокарах, что может способствовать повышению популярности электроавтомобилей и привести к более широкому использованию их в ближайшем будущем, а это должно положительно сказаться на экологии планеты. Напомним, что подзарядить современный электрокар можно лишь за несколько часов; если этот процесс ускорить в сто с лишним раз, проблема заправки таких авто будет практически решена.
Конечно, останется еще одна трудно решаемая задача: современные аккумуляторы, которые используются в электромобилях, слишком дороги. По мнению аналитиков, владельцы таких средств передвижения могли бы согласиться даже с длительностью зарядки батарей, если бы те вдруг стали дешевыми. Поэтому главная задача современных ученых - создать не столько быстрозаряжающиеся АКБ, сколько дешевые и долговечные, например, работающие без снижения своих показателей десять и более лет.
Тем не менее, достижения южнокорейских ученых нельзя недооценивать, поскольку быстро заряжать батареи – это очень удобно и экономично.
Самозаряжающийся аккумулятор
Необычный самозаряжающийся литий-ионный аккумулятор создали ученые из Технологического института Джорджии. Всего одно принципиальное изменение в химическом составе позволяет новой АКБ самозаряжаться при сгибании либо сжатии.
Исследователи всего лишь заменили обычный в таких аккумуляторах пластиковый барьер-электролит, накапливающий электричество, на слой пьезоэлектрических нанотрубок, который способен преобразовывать механическую силу в нужную электроэнергию. Таким образом, получился гибридный аккумулятор, который является также преобразователем энергии.
Кстати, подобные преобразователи энергии предусматривают наличие того или иного электрогенератора, например, солнечной батареи, ветряка и так далее. Кроме того, все эти установки в идеале должны иметь еще ёмкости для хранения вырабатываемой электроэнергии. В большинстве случаев в качестве них выступают как раз литий-ионные аккумуляторы, которые преобразуют вырабатываемое ветряками либо солнечными батареями электричество в химическую энергию, пригодную для длительного хранения.
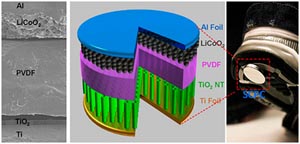
Новый аккумулятор ученых из Технологического института Джорджии практически устраняет в этой цепочке процесс выработки электроэнергии, сразу же преобразуя механическую силу воздействия в химическую энергию.
Как утверждают создатели уникальной АКБ, она не нуждается в источнике тока для подзарядки своей аккумуляторной части. По этой причине такая батарея может найти широкое применение в портативной технике, где не требуется огромного напряжения, зато механических воздействий на аккумулятор может быть более чем достаточно. Именно такую небольшую АКБ величиной с монету и создали американские исследователи. Заменив полиэтилен, разъединяющий два электрода, пленкой PVDF (поливинилиденфторид), которая выступает как пьезоэлектрический генератор, ученые тем самым создали небольшой самозаряжающийся аккумулятор. При сжатии генератор PVDF создает напряжение и тем самым подзаряжает батарейку.
В целях тестирования новая АКБ была установлена в пяточную область кроссовки. Как оказалось, давления, возникающего при ходьбе, вполне достаточно, чтобы аккумулятор постоянно подзаряжался за счет сжатия.
Об аккумуляторе-спрее
Американские ученые из Католического университета Лувена и Университета Райса научились создавать аккумуляторы путем нанесения на ту или иную поверхность (с помощью распыления) специального спрея. Такая краска представляет собой слои жидких металлов (литий-оксид кобальта – катод, гелевый электролит - разделитель, литиевая окись титана - анод, медь – токосъемник), именно они способны накапливать и хранить энергию.

При этом спрей можно нанести, например, на стекло, керамическую плитку, гибкую пленку, стальную пластину и даже на керамическую посуду, скажем, кофейную чашку. На всех этих столь разных поверхностях уникальная батарея сохраняет одинаковую работоспособность. В одном из экспериментов ученые даже подключили необычную АКБ к солнечному генератору, а затем заставили на ней работать светодиодный дисплей – эксперимент удался на славу! Теперь главное – «вынести» уникальный аккумулятор из лаборатории, то есть коммерциализировать его, что будет очень кстати для соединения АКБ с новыми тонкопленочными солнечными батареями с целью интеграции их в фасады и окна современных зданий.
Новое слово в железо-никелевом аккумуляторе
А вот исследователи из Стэнфордского университета сумели вдохнуть новую жизнь в старый железо-никелевый аккумулятор, который давно уже не используется.

К слову, разработана такая батарея была еще в конце девятнадцатого столетия Томасом Эдисоном, и предназначалась она для первых автомобилей, появившихся тогда в мире. Со временем такие аккумуляторы совершенствовались, но в середине семидесятых годов прошлого века, с появлением литий-ионных батарей, потребность в старых АКБ пропадает, и на сегодняшний день их выпуск налажен только в отдельных компаниях, которые производят такие аккумуляторы в основном для хранения излишков электроэнергии, получаемой от ветряков и солнечных батарей.
Заметим, что батарея Эдисона отличается долговечностью, но у нее слишком маленькая скорость разрядки, да и заряжается она чересчур медленно. И вот ученые Стэнфордского университета сумели создать очень шустрый железо-никелевый аккумулятор, который способен заряжаться всего за пару минут, а разряжается в несколько секунд. По скромным подсчетом, новая АКБ превосходит своей скоростью старый аккумулятор почти в тысячу раз.
Исходя из того что усовершенствованный аккумулятор Эдисона дешевый, а теперь еще и сверхскоростной, можно предположить, что в будущем он найдет широкое применение в автомобильной промышленности, как того и хотел великой ученый.
Растущий аккумулятор
Ученые из Environmental Molecular Sciences Lab (EMSL) сумели придумать новый тип анода аккумулятора, состоящий из одиночных наночастиц кремния, которые помещены внутрь углеродной оболочки – наподобие того, как желток находится внутри яйца.
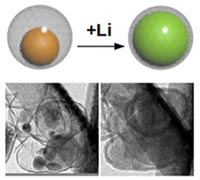
Если в обычных батареях электроны перемещаются к катоду от анода и, встречая на своем пути электролитную перемычку, инициируют в ней химические реакции, в результате чего и высвобождаются электроны, то в батареях EMSL электроны перемещаются не только через электролит к катоду, но и через углеродные оболочки – к кремнию. А последний способен вместить их во много раз больше, чем графитный электрод. К тому же внутри самой углеродной оболочки достаточно много свободного места, необходимого для роста кремния в размере. Поэтому такой аккумулятор не просто заряжается, но еще и растет в это время.
Самый большой аккумулятор находится в Китае в провинции Хэбэй. Аккумулятор создан общими усилиями государственной электросетевой корпорации Китая (SGCC) и компании BYD, производителя электротранспорта и источников накопления энергии. Затраченный на создание аккумулятора капитал превысил 500 млн. долларов. Комплекс объявлен властями Китая как крупнейшее в мире устройство для хранения электроэнергии.

Самая мощная в мире аккумуляторная батарея способна сохранять до 36 мегаватт часов электроэнергии, каждый из ее отсеков имеет размеры футбольного поля. Запаса электричества в ней хватит, чтобы обеспечить в течение часа 12 000 домов при полном отключении электросети. Кроме решения первостепенной задачи, важной для обеих компаний – создания сверхмощного аккумулятора, его авторы получили мировую известность.
Питание аккумулятора осуществляется от ветровых и солнечных батарей общей мощностью 140 МВт, что дает возможность увеличить эффективное использование альтернативных видов энергии на 10%. Недостатком таких источников питания является нестабильность потока электрической энергии от электростанций к аккумулятору, которая выражается в частых провалах и пиках потребления. Чтобы нивелировать нестабильность потока, применяют дополнительные энергетические установки.
Комплекс стал одним из элементов энергетической системы, которая включает гелиостанции и ветрогенерирующие станции, а также интеллектуальную систему управления. Активное включение альтернативных источников энергии в единую государственную электросеть позволило снизить стоимость 1 кВт часа энергии. Система послужит платформой для развития будущих проектов. Строительство самого большого аккумулятора в мире стало вызовом для энергетиков всего мира, которые ограничиваются в основном разговорами о необходимости использования устройств хранения энергии.
6. Топливные элементы
Топливный элемент — это электрохимическое устройство преобразования энергии, которое за счет химической реакции преобразовывает водород и кислород в электричество. В результате этого процесса образуется вода и выделяется большое количество тепла. В одной из статей в интернете я нашёл такую фразу: «Топливный элемент очень похож на аккумулятор, который можно зарядить и затем использовать накопленную электрическую энергию». Смею вас заверить, что это абсолютная чушь! Топливный элемент НЕ МОЖЕТ накапливать энергию, как аккумулятор, его нельзя зарядить! Топливный элемент обеспечивает прямое преобразование химической энергии в электрическую. Почти то же самое происходит в электрических аккумуляторах, но топливные элементы имеют два важных отличия:
преобразовывает водород и кислород в электричество. В результате этого процесса образуется вода и выделяется большое количество тепла. В одной из статей в интернете я нашёл такую фразу: «Топливный элемент очень похож на аккумулятор, который можно зарядить и затем использовать накопленную электрическую энергию». Смею вас заверить, что это абсолютная чушь! Топливный элемент НЕ МОЖЕТ накапливать энергию, как аккумулятор, его нельзя зарядить! Топливный элемент обеспечивает прямое преобразование химической энергии в электрическую. Почти то же самое происходит в электрических аккумуляторах, но топливные элементы имеют два важных отличия:
1) они функционируют до тех пор, пока топливо и окислитель поступают
из внешнего источника;
2) химический состав электролита в процессе работы не изменяется,
т.е. топливный элемент ненуждается в перезарядке.
Изобретателем топливного элемента считают Вильяма Р. Грува (1811-1896), который изобрел его еще в 1839 г. В этом топливном элементе в качестве электролита использовался раствор серной кислоты, а в качестве топлива — водород, который соединялся с кислородом в среде окислителя. Следует отметить, что до недавнего времени топливные элементы использовались только в лабораториях и на космических аппаратах.
В перспективе топливные элементы смогут составить конкуренцию многим другим системам для преобразования энергии, включая газовую турбину на электростанциях, ДВС в автомобиле и электрическим батарейкам в портативных устройствах. ДВС сжигают топливо и используют давление, созданное расширением выделяющихся при сгорании газов,  для выполнения механической работы. Аккумуляторные батареи хранят электрическую энергию, преобразовывая ее затем в химическую энергию, которая при необходимости может быть преобразована обратно в электрическую энергию. Потенциально топливные элементы очень эффективны. Еще в 1824 г. французский ученый Сади Карно (1796-1832) доказал, что циклы сжатия-расширения двигателя внутреннего сгорания не могут обеспечить КПД преобразования тепловой энергии (являющейся химической энергией сгорающего топлива) в механическую выше 50%. Топливный элемент не имеет движущихся частей (по крайней мере, внутри самого элемента), и поэтому они не подчиняются закону Карно. Естественно, они будут иметь больший, чем 50%, КПД и особенно эффективны при малых нагрузках. Таким образом, автомобили с топливными элементами готовы стать (и уже доказали это) более экономичными, чем обычные автомобили в реальных условиях движения.
для выполнения механической работы. Аккумуляторные батареи хранят электрическую энергию, преобразовывая ее затем в химическую энергию, которая при необходимости может быть преобразована обратно в электрическую энергию. Потенциально топливные элементы очень эффективны. Еще в 1824 г. французский ученый Сади Карно (1796-1832) доказал, что циклы сжатия-расширения двигателя внутреннего сгорания не могут обеспечить КПД преобразования тепловой энергии (являющейся химической энергией сгорающего топлива) в механическую выше 50%. Топливный элемент не имеет движущихся частей (по крайней мере, внутри самого элемента), и поэтому они не подчиняются закону Карно. Естественно, они будут иметь больший, чем 50%, КПД и особенно эффективны при малых нагрузках. Таким образом, автомобили с топливными элементами готовы стать (и уже доказали это) более экономичными, чем обычные автомобили в реальных условиях движения.
Топливный элемент обеспечивает выработку электрического тока постоянного напряжения, который может использоваться для привода в действие электродвигателя, приборов системы освещения и других электросистем в автомобиле.
Имеются несколько типов топливных элементов, различающихся используемыми химическими процессами. Топливные элементы обычно классифицируются по типу используемого в них электролита, который они используют. Некоторые типы топливных элементов являются перспективными для применения их в качестве силовых установок электростанций, а другие могут быть полезны для маленьких портативных устройств или для привода автомобилей.
Щелочной топливный элемент — это один из самых первых разработанных элементов. Они использовались в космической программе США, начиная с 1960-х гг. Такие топливные элементы очень восприимчивы к загрязнению и поэтому они требуют очень чистого водорода и кислорода. Кроме того, они очень дороги, и поэтому этот тип топливного элемента, скорее всего, не найдет широкого применения на автомобилях.
Топливные элементы на основе фосфорной кислоты могут найти применение в стационарных установках невысокой мощности. Они работают при довольно высокой температуре и поэтому требуют длительного времени для своего прогрева, что также делает их неэффективными для использования в автомобилях.
Твердоокисные топливные элементы лучше подходят для крупных стационарных генераторов электроэнергии, которые могли бы обеспечивать электричеством заводы или населенные пункты. Этот тип топливного элемента работает при очень высоких температурах (около 1000 °C). Высокая рабочая температура создает определенные проблемы, но, с другой стороны, имеется преимущество — пар, произведенный топливным элементом, может быть направлен в турбины, чтобы выработать большее количество электричества. В целом это улучшает суммарную эффективность системы.
Одна из наиболее многообещающих систем — протонно-обменный мембранный топливный элемент — ПОМТЭ (PEMFC — Protone Exchange Membrane Fuel Cell). В настоящий момент этот тип топливного элемента является наиболее перспективным, поскольку он может приводить в движение автомобили, автобусы и другие транспортные средства.
Химические процессы в топливном элементе
В топливных элементах применяется электрохимический процесс соединения водорода с кислородом, получаемым из воздуха. Как и в аккумуляторных батареях, в топливных элементах используются электроды (твердые электрические проводники) находящиеся в электролите (электрически проводимая среда). Когда в контакт с отрицательным электродом (анодом) входят молекулы водорода, последние разделяются на протоны и электроны. Протоны проходят через протонно-обменную мембрану (ПОМ) на положительный электрод (катод) топливного элемента, производя электричество. Происходит химическое соединение молекул водорода и кислорода с образованием воды, как побочного продукта этой реакции. Единственный вид выбросов от топливного элемента — водяной пар.

Электричество, произведенное топливными элементами, может использоваться в электрической трансмиссии автомобиля (состоит из преобразователя электроэнергии и асинхронного двигателя переменного тока) для получения механической энергии для привода в движение автомобиля. Работа преобразователя электроэнергии заключается в преобразовании постоянного электрического тока, произведенного топливными элементами, в переменный ток, на котором работает тяговый электродвигатель транспортного средства.
Схема устройства топливного элемента с протонно-обменной мембраной:
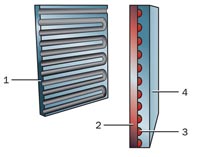
1 — анод;
2 — протонно-обменная мембрана (РЕМ);
3 — катализатор (красный);
4 — катод
Протонно-обменная мембрана топливного элемента (PEMFC) использует одну из самых простых реакций любого топливного элемента.
Отдельная ячейка топливного элемента

Рассмотрим, как устроен топливный элемент. Анод, отрицательный полюс топливной ячейки, проводит электроны, которые освобождены от водородных молекул, чтобы они могли использоваться во внешнем электрическом контуре (цепи). Для этого в нем гравируются каналы, распределяющие водород равномерно по всей поверхности катализатора. Катод (положительный полюс топливной ячейки) имеет гравированные каналы, которые распределяют кислород по поверхности катализатора. Он также проводит электроны назад от внешнего контура (цепи) до катализатора, где они могут соединиться с водородными ионами и кислородом с образованием воды. Электролит — протоннообменная мембрана. Это особый материал, похожий на обычный пластик, но обладающий способностью пропускать положительно заряженные ионы и блокировать проход электронов.
Катализатор — специальный материал, который облегчает реакцию между кислородом и водородом. Катализатор обычно изготавливается из платинового порошка, нанесенного очень тонким слоем на углеродистую бумагу или ткань. Катализатор должен быть шероховатым и пористым, для того чтобы его поверхность могла максимально соприкасаться с водородом и кислородом. Покрытая платиной сторона катализатора находится перед протонно-обменной мембраной (ПОМ).
Газообразный водород (Н2) подается в топливный элемент под давлением со стороны анода. Когда молекула H2 входит в контакт с платиной на катализаторе, она разделяется на две части, два иона (H+) и два электрона (e–). Электроны проводятся через анод, где они проходят через внешний контур (цепь), выполняя полезную работу (например, приводя в действие электродвигатель) и возвращаются со стороны катода топливного элемента.
Тем временем со стороны катода топливного элемента газообразный кислород (O2) продавливается через катализатор, где он формирует два атома кислорода. Каждый из этих атомов имеет сильный отрицательный заряд, который обеспечивает притяжение двух ионов H+ через мембрану, где они объединяются с атомом кислорода и двумя электронами из внешнего контура (цепи) с образованием молекулы воды (H2O).
Эта реакция в отдельном топливном элементе производит мощность приблизительно 0,7 Вт. Чтобы поднять мощность до требуемого уровня, необходимо объединить много отдельных топливных элементов, чтобы сформировать батарею топливных элементов.
Топливные элементы на основе ПОМ работают при относительно низкой температуре (около 80 °С), а это означает, что они могут быть быстро нагреты до рабочей температуры и не требуют дорогих систем охлаждения. Постоянное совершенствование технологий и материалов, используемых в этих элементах, позволили приблизить их мощность к уровню, когда батарея таких топливных элементов, занимающая небольшую часть багажника автомобиля, может обеспечить энергию, необходимую для привода автомобиля.
На протяжении последних лет большинство из ведущих мировых производителей автомобилей инвестируют большие средства в разработку конструкций автомобилей, использующих топливные элементы. Многие уже продемонстрировали автомобили на топливных элементах с удовлетворительными мощностными и динамическими характеристиками, хотя они имели довольно высокую стоимость.
Совершенствование конструкций таких автомобилей происходит очень интенсивно.
Автомобиль на топливных элементах, использует силовую установку, расположенную под полом автомобиля

Автомобиль NECAR V изготовлен на базе автомобиля Mercedes-Benz А-класса, причем вся силовая установка вместе с топливными элементами расположена под полом автомобиля. Такое конструктивное решение дает возможность разместить в салоне автомобиля четырех пассажиров и багаж. Здесь в качестве топлива для автомобиля используется не водород, а метанол. Метанол с помощью реформера (устройства, перерабатывающего метанол в водород), преобразуется в водород, необходимый для питания топливного элемента. Использование реформера на борту автомобиля дает возможность использовать в качестве топлива практически любые углеводороды, что позволяет заправлять автомобиль на топливных элементах, используя имеющуюся сеть заправок. Теоретически топливные элементы не производят ничего, кроме электричества и воды. Преобразование топлива (бензина или метанола) в водород, необходимый для топливного элемента, несколько снижает экологическую привлекательность такого автомобиля.
Компания Honda, которая занимается топливными элементами с 1989 г., изготовила в 2003 г. небольшую партию автомобилей Honda FCX-V4 с протонно-обменными топливными элементами мембранного типа фирмы Ballard. Эти топливные элементы вырабатывают 78 кВт электрической мощности, а для привода ведущих колес используются тяговые электродвигатели мощностью 60 кВт и с крутящим моментом 272 Н•м. Автомобиль на топливных элементах, по сравнению с автомобилем традиционной схемы, имеет массу примерно на 40 % меньшую, что обеспечивает ему отличную динамику, а запас сжатого водорода дает возможность пробега до 355 км.
Автомобиль Honda FСX использует для движения электрическую энергию, получаемую с помощью топливных элементов

Автомобиль Honda FCX — первый в мире автомобиль на топливных элементах, который прошел государственную сертификацию в США. Автомобиль сертифицирован по нормам ZEV — Zero Emission Vehicle (автомобиль с нулевым загрязнением). Компания Honda не собирается пока продавать эти автомобили, а передает порядка 30 автомобилей в лизинг в шт. Калифорния и г. Токио, где уже существует инфраструктура водородных заправок.
Концептуальный автомобиль Hy Wire компании General Motors имеет силовую установку на топливных элементах
Большие исследования по разработке и созданию автомобилей на топливных элементах проводит компания General Motors.
Шасси автомобиля Hy Wire

При создании концептуального автомобиля GM Hy Wire было получено 26 патентов. Основу автомобиля составляет функциональная платформа толщиной 150 мм. Внутри платформы располагаются баллоны для водорода, силовая установка на топливных элементах и системы управления автомобиля, использующие новейшие технологии электронного управления по проводам. Шасси автомобиля Hy Wire представляет собой платформу небольшой толщины, в которой заключены все основные элементы конструкции автомобиля: баллоны для водорода, топливные элементы, аккумуляторы, электродвигатели и системы управления. Такой подход к конструкции дает возможность в процессе эксплуатации менять кузовы автомобиля Компания также проводит испытания опытных автомобилей Opel на топливных элементах и проектирует завод по производству топливных элементов.
Конструкция «безопасного» топливного бака для сжиженного водорода:
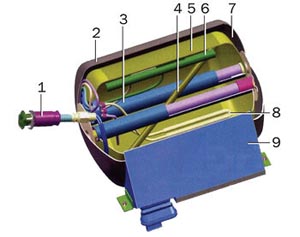 1 — заправочное устройство;
1 — заправочное устройство;
2 — наружный бак;
3 — опоры;
4 — датчик уровня;
5 — внутренний бак;
6 — заправочная линия;
7 — изоляция и вакуум;
8 — нагреватель;
9 — крепежная коробка
Проблеме использования водорода в качестве топлива для автомобилей уделяет много внимания компания BMW. Совместно с фирмой Magna Steyer, известной своими работами по использованию сжиженного водорода в космических исследованиях, BMW разработала топливный бак для сжиженного водорода, который может использоваться на автомобилях.
Первый в мире серийный автомобиль с топливным элементом вместо аккумуляторной батареи

В 2003 г. фирма BMW объявила о выпуске первого серийного автомобиля с топливным элементом BMW 750 hL. Батарея топливных элементов используется вместо традиционного аккумулятора. Этот автомобиль имеет 12-цилиндровый двигатель внутреннего сгорания, работающий на водороде, а топливный элемент служит альтернативой обычному аккумулятору, обеспечивая возможность работы кондиционера и других потребителей электроэнергии при длительных стоянках автомобиля с неработающим двигателем.
Заправка водородом производится роботом, водитель не участвует в этом процессе

Эта же фирма BMW разработала также роботизированные заправочные колонки, которые обеспечивают быструю и безопасную заправку автомобилей сжиженным водородом.
Появление в последние годы большого количества разработок, направленных на создание автомобилей, использующих альтернативные виды топлива и альтернативные силовые установки, свидетельствует о том, что двигатели внутреннего сгорания, которые доминировали на автомобилях в течение прошедшего столетия, в конце концов уступят дорогу более чистым экологически, эффективным и бесшумным конструкциям. Их широкое распространение на данный момент сдерживается не техническими, а, скорее, экономическими и социальными проблемами. Для их широкого применения необходимо создать определенную инфраструктуру по развитию производства альтернативных видов топлива, созданию и распространению новых заправочных станций и по преодолению ряда психологических барьеров. Использование водорода в качестве автомобильного топлива потребует решения вопросов хранения, доставки и распределения, с принятием серьезных мер безопасности.
Теоретически водород доступен в неограниченном количестве, но его производство является весьма энергоемким. Кроме того, для перевода автомобилей на работу на водородном топливе необходимо произвести два больших изменения системы питания: сначала перевести ее работу с бензина на метанол, а затем, в течение некоторого времени и на водород. Пройдет еще некоторое время, перед тем как этот вопрос будет решен.
7. ЭКСПЕРИМЕНТ!
Как известно, самостоятельно можно изготовить что угодно. Необходимо желание, умение, материалы, инструменты, время, место и т.п. Принцип действия гальванических элементов настолько прост и очевиден, что сделать их своими руками, буквально, не составляет никакого труда. А вот фантазия необходима. В интернете тому масса примеров. Приведу некоторые из них.
Батарейки из фруктов и овощей
Для изготовления надо иметь: фрукты и/или овощи, сок которых представляет собой электролит, т.к. содержит растворы солей и органических кислот; кусочки различных металлов или металлические предметы, которые можно воткнуть в овощ или фрукт; мультиметр с проводочками, чтобы оценить величину развиваемой источником ЭДС.
Втыкаем в лимон или апельсин два электрода из разных металлов (оцинкованный гвоздик и кусок медной проволоки, например), подключаем мультиметр и оцениваем результат, который может быть от 0,4 до 1,5 В в зависимости от используемых металлов.
Можно использовать грейпфрут, яблоко, картофель и другие.



В случае использования цитрусовых эксперимент будет выглядеть весьма эффектно, если плод разрезать поперёк и вставить в него электроды.


Из нескольких «фруктовых» элементов можно составить батарейку.

Багдадская (Парфянская) батарейка
И «на десерт» ретро-рецепт из 60-х ХХ века.
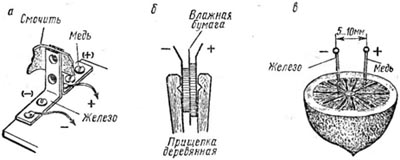
Простейший гальванический элемент (разновидность элемента Вольта) состоит из стальной и медной пластин, разделенных слоем промокательной бумаги (15х40 мм), пропитанной обыкновенной водопроводной водой или просто слюной (рис. а). Если элемент не будет работать, бумагу надо намочить в растворе поваренной соли (полчайной ложки на стакан воды). Такой «водяной» источник питания, приводящий в действие какое-либо устройство (радиоприемник, зуммер и т.п.) удивляет непосвященных наблюдателей. Больший эффект дает применение медных, цинковых или оловянных пластин. Такой элемент состоит из деревянной или пластмассовой бельевой прищепки, медной, серебряной или никелевой монеты и прокладки из влажной газетной бумаги (рис. б). ЭДС элемента будет около 0,1 В и их можно соединить в батарею. Достаточно ввести два проводника — железный и медный (рис. в) в лимон, яблоко или в соленый огурец (а еще лучше – в пиво), чтобы получить источник тока с ЭДС 0,1 В. Соединив несколько таких элементов, будем иметь батарею, пригодную для питания простейшего радиоприемника.
Энергию для радиоприемника можно черпать не только из антенны (см. мою статью «Простейший радиоприёмник»), но и из земли. Это неплохой метод питания радиоустройств на экскурсиях, в палатках, кемпинге и т.п. Если такой элемент поместить глубоко в землю (глубже слоя промерзания, в среднем на глубину 1 м.),то им можно будет пользоваться непрерывно в течение года.
Конструкция «земляного» элемента показана на рисунке. Качество его работы зависит от вида почвы, её влажности, а также от размеров и материала электродов, более пригодна влажная жирная почва. Чем больше поверхность электродов, тем меньше внутреннее сопротивление источника тока. Вид материала электродов мало влияет на величину электродвижущей силы источника, которая обычно меняется в пределах 0,8... 1,1 В.
Наилучшие результаты дают следующие гальванические пары: цинк— уголь, алюминии — медь, цинк — медь. Если к элементу подключить какую-либо нагрузку, то его напряжение будет постепенно уменьшаться пока не стабилизируется по истечении 15…30 мин. Если имеются типовые цинковые пластин (170 х 210 мм) и угольные электроды от больших телефонных батарей (можно также использовать угольные стержни от 1,5-вольтовых элементов),то расстояние между электродами может быть 0,3…0,5м.
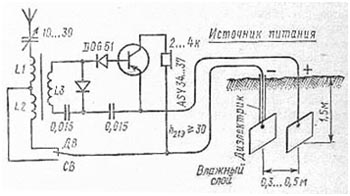
Отводы от положительных электродов выполняются изолированным проводом. Соединение с электродами выполняется сваркой или пайкой. Наивысший КПД такого элемента достигается при токе нагрузки 1…2 мA.
На рисунке ниже изображена схема детекторного приемника с питанием от земляного элемента, который состоит из двух круглых стержней — стального (2,5 X 400 мм) и медного (4X400 мм), разнесенных на расстояние 50 мм. Такой элемент работал в режимах 0,5 В/0,25 мА при сухой почве и 0,75 В/0,9 мА — при влажной.
Для удовлетворительной работы простого приемника, питаемого «земляным» элементом, необходимо сделать наружную антенну длиной не менее 4 м и подвесить ее на высоте не ниже 5 м от земли (чем выше, тем лучше). Если после нескольких месяцев работы напряжение элемента под нагрузкой уменьшится, следует увеличить площадь электродов.
В завершение хочу отметить, что за время моей жизни количество, качество, многообразие, возможности применения ХИТов претерпели весьма сильные изменения. Я помню те времена, когда трудно было разыскать элементы  и батарейки
и батарейки  . Потом появились
. Потом появились  .
.
Моя первая электрифицированная игрушка примерно 1966-67 года – гусеничный вездеход без ПДУ, с переключателем «верёд – стоп – назад» стоимостью 5р.50к. По тем временам цена совсем не маленькая! Так вот мне приходилось по 2-3 месяца ждать, пока из Москвы родственники привезут батарейки «КБС-Л-0,50», а для машинки их требовалось сразу две. Хотя цена батарейки составляла 17 к., найти их в провинции было, практически, нереально. Это факт.
Я не нашёл в Интернете фото той моей игрушки, а вот её реальный прототип:

© SEkorp /моя версия темы, 30 апреля 2016/
НАЗАД на страницу РАДИОпитание
